神经元的极化特性是其形成复杂神经回路,维持生理功能的重要基础,轴突和树突上囊泡的选择性转运是神经元极化形成和维持的基础。轴突起始段(Axon initial segment, AIS)位于神经元体细胞和轴突之间,这种精确的结构需要骨架蛋白,驱动蛋白(Kinesin)和动力蛋白(Dynein)的共同作用,参与筛选进入轴突的囊泡。一些研究认为AIS区域致密的骨架网络和囊泡表面受体是囊泡极性转运的基础,而对于不同囊泡筛选的具体机制,依然不够清楚。沿微管顺行的驱动蛋白(Kinesin)将含有轴突蛋白的囊泡转运至轴突远端,而含有树突蛋白的囊泡几乎不进入轴突,如神经元上的转铁蛋白受体(Transferrin receptor , TfR)几乎全部定位于成熟神经元胞体和树突上。
转铁蛋白受体在细胞质膜上从循环转铁蛋白(Tf)摄取铁,细胞表面形成的TfR-Tf复合物被递送到核内体。

本研究作者在前期已经证明驱动蛋白Kinesin-3家族的KIF13A负责TfR囊泡的转运。当携带TfR囊泡的驱动蛋白进入AIS后,其移动速率降低,并返回胞体。在初级海马神经元中过表达KIF13A并记录含有TfR的囊泡的运动。发现KIF13A过表达导致TfR囊泡大量进入轴突,降低了TfR囊泡在树突-轴突大的比率。有趣的是,过表达KIF13A时,含有TfR的囊泡开始进入轴突,但它们没有与NgCAM囊泡共定位,表明TfR没有被错误地分选到轴突囊泡中。因此,过表达的KIF13A可能干扰了囊泡的转运期,而不是分选期。将突变位点(Ser221Ala, His222Ala)引入KIF13A (KIF13A-mm)的马达结构域,使其无法水解ATP。过表达KIF13A-mm时,在轴突中未观察到TfR囊泡,并导致树突到轴突囊泡传递的比例更高。证实KIF13A的转运过程介导了TfR囊泡的轴突传递。此外,构建包含KIF13A的运动结构域和KIF13B的尾部结构域的融合蛋白,该嵌合体(KIF13A- B)的表达不会像KIF13A那样改变树突和轴突递送TfR囊泡的比例。相反,含有KIF13B的运动域和KIF13A的尾域 (KIF13B- A)的嵌合体的表达诱导了TfR囊泡的轴突运输,表明是KIF13A尾部结构域过参与TfR轴突运输调控。为探索可能调节KIF13A对极化囊泡运输的上游蛋白,通过设计了编码KIF13A尾部结构域的质粒,将其融合到大肠杆菌生物素连接酶BioID2中,在HEK293T细胞中表达并富集与KIF13A相互作用物的生物素化蛋白。通过筛选发现微管亲和调节激酶2(MARK2/ Par1), 与神经元极性建立和维持有关。且已有研究表明Par1b/MARK2在蛋白14-3-3的结合位点磷酸化KIF13B,从而调节轴突形成。免疫共沉淀和超分辨显微镜结果显示,KIF13A尾部与mark2的相互作用片段与TfR囊泡的结合片段一致,表明Par1b/MARK2参与调控其极性筛选。
为阐明MARK2磷酸化KIF13A如何影响TfR囊泡的极化运输,通过CRISPR-Cas9技术敲除MARK2,发现敲除增加了输送到轴突的TfR囊泡比例,这与过表达KIF13A Ser1371Ala(14-3-3亲和结构域中的关键磷酸化位点抑制性突变)的大鼠胚胎成纤维细胞中观察到的结果一致。当KIF13A和MARK2一起过表达时,这些囊泡的树突转运部分恢复,而当过表达的MARK2含有活性位点抑制型突变Ser212Asp (MARK2- KD)时,TfR囊泡的极性转运没有恢复。
该研究为轴突物质的选择性转运提供了一个新的视角,即囊泡的极性转运可能与轴突起始区域富集的蛋白激酶调控相关。是对动力蛋白(Dynein), 分子筛理论(Actin filter)和肌球蛋白V(Myosinv)等轴突蛋白筛选理论的一个补充。
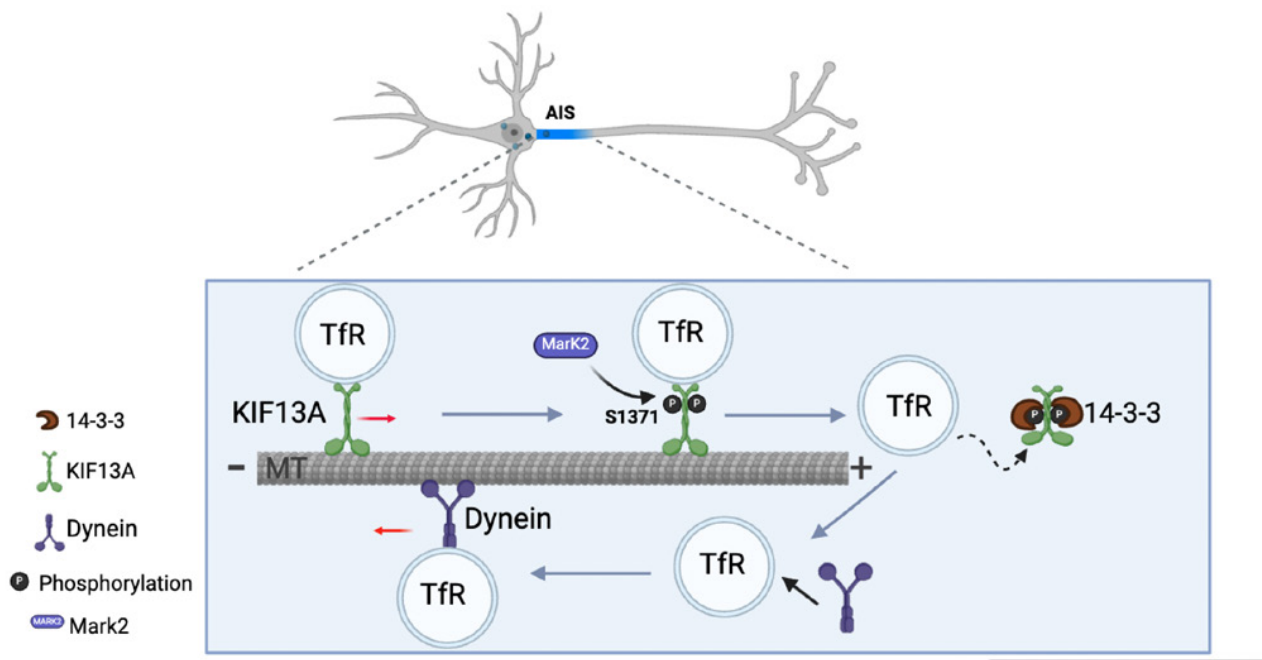
轴突起始区域MARK2磷酸化KIF13A的14-3-3结合结构域模型
该研究近期以《MARK2磷酸化KIF13A的14-3-3结合位点调控转铁蛋白受体囊泡在树突上的极化转运》(MARK2 phosphorylates KIF13A at a 14-3-3 binding site to polarize vesicular transport of transferrin receptor within dendrites)为题发表在《美国科学院院刊》(PNAS)上。西安交通大学医学部基础医学院/转化医学研究院为第一作者单位和通讯作者单位。该研究工作得到国家自然科学基金和西安交通大学“青年拔尖人才”计划等资助。
杨睿:文章通讯作者,西安交通大学基础医学院教授。毕业于德国马普所-明斯特大学联合博士项目,先后在俄勒冈健康与科学大学(OHSU)和杜克大学医学院从事博士后研究工作, 导师为神经元极化领域资深科学家(Senior Scientist) Prof. Dr. Gary Banker, 和美国科学院院士,HHMI 研究员Prof. Dr. Vann Bennett. 期间,在神经元囊泡的极化转运和轴突锚定蛋白研究领域取得重要成果,并于2019年入职耶鲁大学 Department of Genetics研究科学家。2020年年底回国后,得到西安交通大学“青年拔尖人才”计划支持,组建实验室,致力于神经细胞形态发育的调控和神经轴突起始位点与大脑的功能研究。
团队:负责人为杨睿教授,成员包括博士后韩岳、刘哲,博士生李敏,研究生赵冰清、刘燕、王慧超。团队得到西安交通大学青年拔尖人才计划、秦创原科技创新项目,国家自然基金以及深圳湾实验室的支持。团队的校内外合作广泛,创新氛围浓厚。
论文链接:https://www.pnas.org/doi/suppl/10.1073/pnas.2316266121
杨睿教授:https://bms.xjtu.edu.cn/info/1073/2075.htm