炎症性肠病(IBD)是一种慢性非特异性炎症性疾病,主要包括溃疡性结肠炎(UC)和克罗恩病(CD)。随着生活水平的提高及饮食结构的变化,IBD在我国的发病率逐年上升,已严重危害人民健康。根据中国疾病预防控制中心预测数据,2025年IBD患者将突破150万。当前的临床干预手段侧重于对症治疗但效果欠佳。因此,发展IBD诊疗新技术、新方法,将为IBD的综合防治提供有效依据,具有重大社会需求。
1、一体化纳米诊疗平台用于UC的生物发光成像及协同抗炎治疗
UC的诊断缺乏金标准,主要结合患者临床表现、内镜和病理组织学进行综合分析。髓过氧化物酶(MPO)催化醛类、次氯酸、羟基自由基等毒性物质的产生,促进炎症反应,造成组织氧化损伤。MPO的表达量与UC的发生发展密切相关,因此,MPO可作为UC的一种诊断指标。鲁米诺在MPO催化作用下产生蓝光,然而,鲁米诺的蓝光波长较短,限制其在活体深层组织成像中的应用。通过生物发光/荧光共振能量转移效应(BRET/FRET),将鲁米诺的蓝光转换为近红外光,有望实现对UC的高灵敏生物发光成像。

BRET-FRET效应可行性分析及对UC的高灵敏生物发光成像。
白藜芦醇(Res)和白桦脂酸(BA)是两种天然化合物,研究表明,Res可以抑制IBD和炎症诱发的结肠癌; BA能降低结肠中MPO和脂质过氧化水平,恢复结肠炎小鼠的过氧化氢酶和超氧化物歧化酶,降低谷胱甘肽水平,显著降低基质金属蛋白酶-9和前列腺素E2的表达。Res与BA联合使用,有望实现更好的抗炎效果。
据此,张明真研究员团队设计了基于聚合物的一体化纳米诊疗平台。该一体化诊疗平台将天然化合物Res和BA靶向递送到结肠炎症部位,在急性和慢性UC模型中发挥协同抗炎作用;基于BRET-FRET效应,将鲁米诺的蓝光转换为近红外光,实现了结肠炎组织的高灵敏生物发光成像。该一体化诊疗平台不但实现了UC的靶向治疗,而且为UC的精准监测提供了一种可选择的方法。
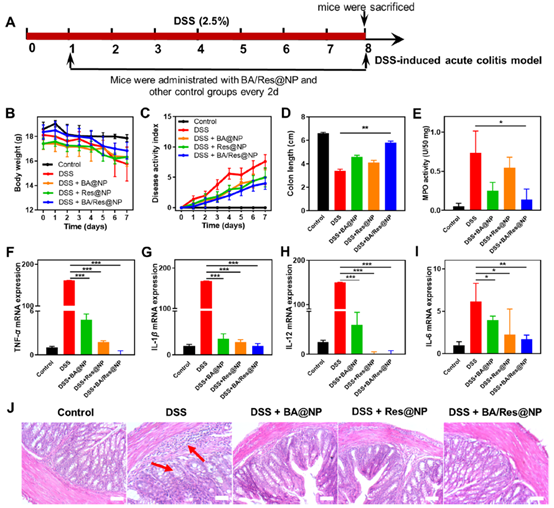
在急性结肠炎模型中,Res与BA表现协同抗炎效果
上述研究成果以《All-in-one theranostic nano-platform based on polymer nanoparticles for BRET/FRET-initiated bioluminescence imaging and synergistically anti-inflammatory therapy for ulcerative colitis》为题发表在Journal of Nanobiotechnology上(IF:10.435),基础医学院博士研究生颜湘冀为论文的第一作者,杭州医学院许秋然教授,一附院涂康生副研究员和基础医学院张明真研究员为论文的共同通讯作者,西安交通大学基础医学院为论文的第一及最后通讯单位。该项研究受到国家自然科学基金、陕西省免疫相关疫病研究科技创新团队、浙江省医药卫生重大科技计划,西安交通大学青年拔尖人才计划等项目的支持。
论文链接:
https://link.springer.com/article/10.1186/s12951-022-01299-8
2、仿生MOF纳米颗粒递送C-Dot纳米酶和CRISPR/Cas9系统治疗UC
活性氧(ROS)是体内一类氧的单电子还原产物,包括超氧阴离子(O2•−)、过氧化氢(H2O2)、羟基自由基(•OH)等。在UC发生发展过程中,ROS除了直接造成肠黏膜组织损伤外,还可以诱导结肠上皮细胞发生氧化应激,造成多种脂质过氧化,脂质过氧化的产生又进一步损伤结肠上皮;ROS同时还具有趋化能力,招募中性粒细胞等免疫细胞进入炎症部位,刺激促炎因子的大量分泌,从而放大肠道炎症反应,导致损伤加剧。CD98是一种II型跨膜糖蛋白,在UC中的表达显著升高。CD98的过表达通过调控免疫细胞激活、肠道菌群及miRNAs的表达等途径加重结肠炎症。
据此,张明真研究员团队构建了共载C-dot纳米酶和CD98 CRISPR/Cas9质粒的pH响应型的仿生递送系统(CCZM),以实现UC的炎症靶向联合治疗。C-dot纳米酶(CNs)和CD98 CRISPR/Cas9质粒(CPs)通过一锅法共封装在pH响应的MOF载体(ZIF-8)中形成CCZ。为了提高靶向能力,巨噬细胞膜通过共挤出CCZ和膜伪装到CCZ纳米颗粒上,引导仿生MOFs在炎症部位积累。静脉给药后,这种递送系统可以通过受损的脉管系统靶向UC的炎症部位。炎症条件的低pH值诱导ZIF-8的分解,导致碳点SOD纳米酶和质粒的释放。释放的纳米酶可以有效消除ROS,重塑炎症微环境;同时,CD98 CRISPR/Cas9质粒下调CD98的表达,从而减轻炎症。因此,C-dot纳米酶和CD98 CRISPR/Cas9系统的联合治疗是一种有效的方法,为UC提供了新的治疗策略。
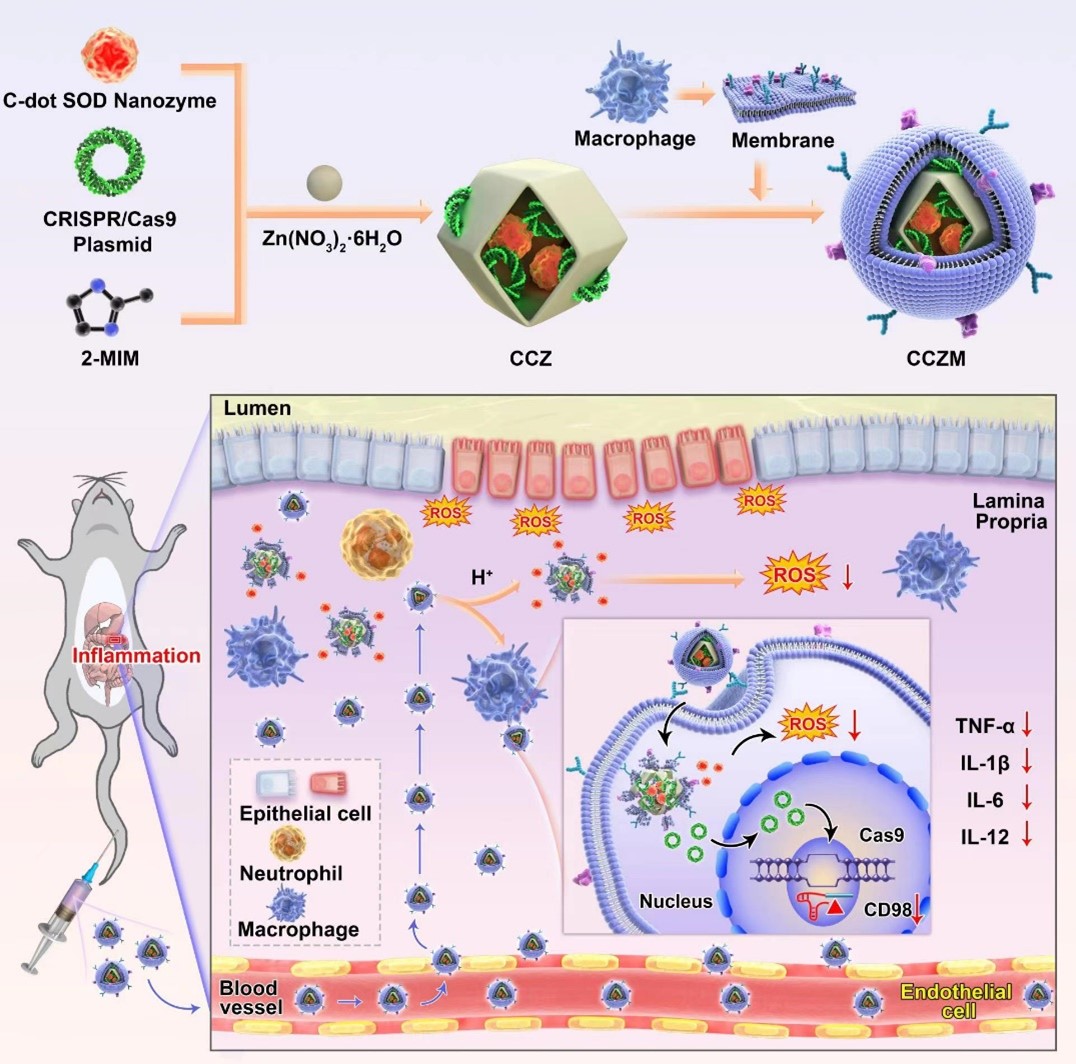
上述研究成果以《Biomimetic MOF Nanoparticles Delivery of C-Dot Nanozyme and CRISPR/Cas9 System for Site-Specific Treatment of Ulcerative Colitis》为题发表在ACS Applied Materials & Interfaces上(IF:9.23),基础医学院博士研究生马雅娜为论文的第一作者,基础医学院刘翠副教授,温州医科大学徐昌隆主任医师和基础医学院张明真研究员为论文的共同通讯作者,西安交通大学基础医学院为论文的第一及最后通讯单位。该项研究受到国家自然科学基金、陕西省免疫相关疫病研究科技创新团队、西安交通大学青年拔尖人才计划等项目的支持。
论文链接:
https://pubs.acs.org/doi/abs/10.1021/acsami.1c21700
3、口服姜黄外泌体样纳米囊泡治疗UC
植物外泌体样纳米囊泡富含生物活性脂质、蛋白质、RNA和其他药理活性分子,作为天然纳米载体具有独特的形态和组成特征。张明真研究员团队从姜黄(Curcuma longa)根茎中获取了姜黄外泌体样纳米囊泡(TDNPs 2),该纳米囊泡具有优异的抗炎、抗氧化性能。在口服条件下,TDNPs 2能安全穿越上消化道并有效富集在结肠炎症部位,通过调控NF-kB信号通路,TDNPs 2显著缓解DSS诱导的溃疡性结肠炎及促进炎症的快速消退。植物外泌体样纳米囊泡生物相容性良好且可大批量分离提取,具有较好的临床应用前景。
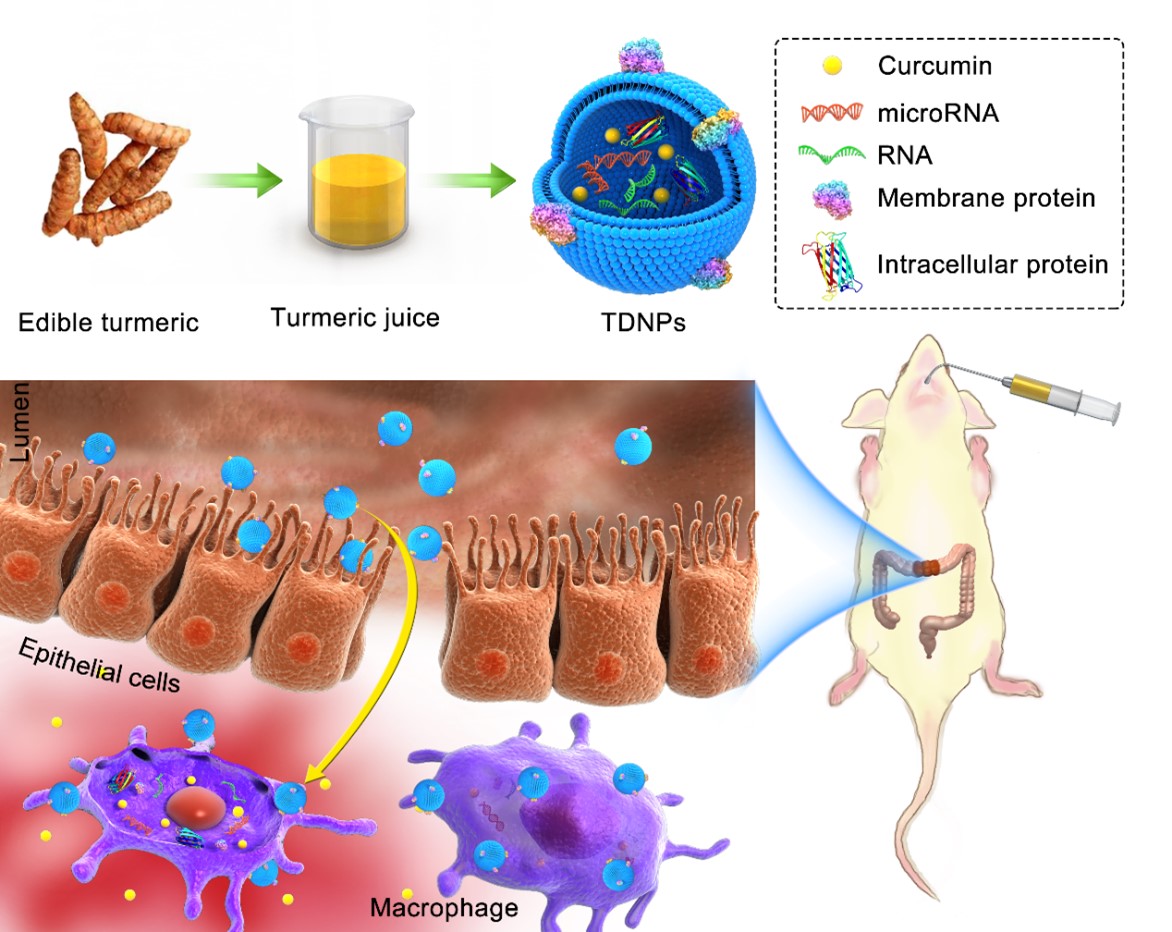
上述研究成果以《Oral administration of turmeric-derived exosome-like nanovesicles with anti-inflammatory and pro-resolving bioactions for murine colitis therapy》为题发表在Journal of Nanobiotechnology上(IF:10.435),基础医学院刘翠,颜湘冀和张玉洁为论文的共同第一作者,杭州医学院许秋然教授,一附院涂康生副研究员和基础医学院张明真研究员为论文的共同通讯作者,西安交通大学基础医学院为论文的第一及最后通讯单位。该项研究受到国家自然科学基金、陕西省免疫相关疫病研究科技创新团队、浙江省医药卫生重大科技计划、西安交通大学青年拔尖人才计划等项目的支持。
论文链接:
https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-022-01421-w