由基础医学院郑芳副教授和生命学院青年教师温玉荣博士为通讯作者,温玉荣博士、博士生欧阳震霖为第一作者的研究论文:“Mechanistic insight into how multidrug resistant Acinetobacter baumannii response regulator AdeR recognizes an intercistronic region”发表在国际生物化学与分子生物学的权威期刊《Nucleic Acids Research》上(影响因子10.162)。西安交通大学为论文的唯一第一和通讯作者单位。该项工作主要研究“超级细菌”的多重耐药调控机制,由西安交通大学生命学院转化医学中心、医学部基础医学院生化研究团队与德国感染中心科隆大学Paul G Higgins教授和比利时根特大学Bart Devreese教授合作完成;生命学院本科生裴应玫,周晓蓉和余悦参与了该项研究工作。
病原菌因多重耐药引起的感染已经成为威胁人类健康的全球性公共安全问题。而鲍曼不动杆菌(Acinetobacter Baumannii)被2017年度世界卫生组织WHO列为危险程度最高的多重耐药的“超级细菌”首位。鲍曼不动杆菌可导致严重的肺炎,脑膜炎,血流感染和泌尿道感染,极易获得对大多数广谱类抗生素的抗性,使得其感染极难被治愈。而其抗生素抵抗的形成和它能通过AdeABC运输泵通过主动运输的方式将抗生素排出密切相关,AdeABC药物运输泵已经确认与鲍曼不动杆菌对氨基糖苷类、四环素类、氟喹诺酮类、氯霉素、红霉素、甲氧苄氨嘧啶和替加环素的抗性密切相关。该项研究工作采用一体化结构生物学方案,揭示响应调控因子AdeR可以通过识别其与AdeABC之间的一段顺反子DNA序列而调控AdeABC运输泵的表达水平。报道了AdeR调控结构域 1.4埃(Ångstrom,1埃=10-10米),AdeR调控结构域与金属镁离子复合物1.6埃以及AdeR DNA结合区域与其靶向的25bp的顺反子DNA的复合物2.75埃晶体结构,并且通过小角度X射线散射实验验证了它们在生理条件下的组装状态,系统性的阐明了直接调控AdeABC药物运输泵的响应调控因子AdeR的调控分子机制。为寻找治疗多重耐药鲍曼不动杆菌的新策略以及新的抗生素研发提供依据。
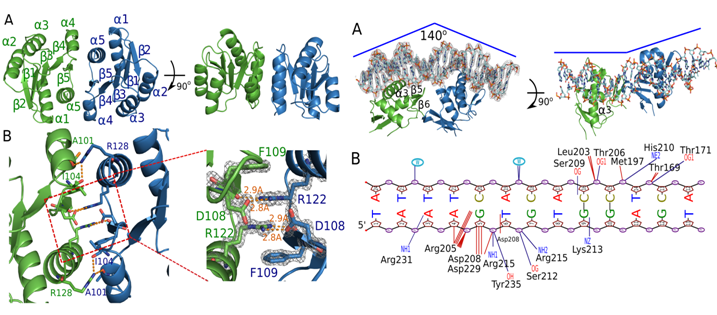
图注:左图为AdeR调控结构域二聚体的晶体结构,右图为AdeR DNA结合区域与顺反子DNA复合物的晶体结构。
` 该项研究得到国家自然科学基金青年项目的资助,X射线晶体学和小角度X射线散射实验是在上海光源国家蛋白质中心BL18U和BL19U完成。研究成果的发表表明西安交通大学在揭示感染因子分子结构方面的研究上了一个新台阶。
论文链接:
https://academic.oup.com/nar/article/3976494/Mechanistic-insight-into-how-multidrug-resistant